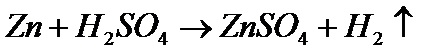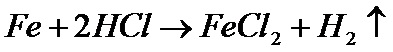Химия для чайников. Урок 4. Водород.
Это последний урок из серии "Химия для чайников", публикуемый в бесплатном разделе. Начиная со следующего, публикация уроков будет продолжена в платном разделе. В бесплатном же разделе, возможно, иногда будут публиковать некоторые статьи, посвященные отдельным вопросам химии.
Самый первым элементов в таблице Менделеева (см. урок Химия для чайников. Урок 3. Таблица Менделеева) стоит водород. Ядро атома водорода состоит из одного протона, поэтому газ водород очень легкий (легче воздуха) и имеет низкую температуру плавления (-259o) и кипения (-253o). Обозначается водород буквой H, первой буквой латинского слова Hydrogenium, что значит "порождающий воду".
Да, кстати, о воде. Молекула воды содержит два атома водорода и один кислорода - H2O - всем известная формула, даже полным чайникам в химии. Для того, что бы водород и кислород превратились в воду, необходимо, что бы эти вещества вступили в химическую реакцию. Но для этого еще недостаточно просто смешать газы. Дело в том, как кислород, так водород состоит не из атомов, а из молекул. Атомы обоих газов сцеплены с друг с другом. Так что для воспламенения смеси нужно подвести к ней определенную энергию. Например, искру. Стоит заметить, что для того, что бы произошел большой бабах, достаточно очень маленькой искры, хотя при комнатной температуре такая смесь можно храниться сколько угодно долго.
Почему же сметь кислорода и водорода так врывоопасна? Дело в том, что при соединении кислорода с водородом выделятся энергия, при чем, гораздо больше, чем затратилось на расщепление молекул этих газов. Так что продукты горения водорода сильно нагреваются, разогревая смесь вокруг. Та, в свою очередь, тоже воспламеняется. И нагревает газ вокруг себя. В общем, получается что то наподобие эффекта домино. И все это происходит очень быстро. Поэтому то и получается взрыв.
Взрывоопасная не только сметь кислорода с водородом, но и даже с обычным воздухов. Именно поэтому такую смесь называют "гремучим газом".
Теперь рассмотрим способы получения водорода. Начнем с лабораторных способов.
1. Реакция разбавленных кислот с металлами. Чаше всего для этих целей используют серную кислоту и цинк. В этом случае происходит вот такая вот реакция:
Иными словами, если кусочек цинка опустить в серную кислоту, то начнется реакция, этот кусочек будет растворяться, на нем появятся такие пузырьки, которые, отрываясь, будут всплывать вверх. В этих пузырьках - водород.
Прежде чем идти дальше, объясню, что обозначает данное химическое уравнение. Правая часть Zn+H2SO4 означает, что надо смешать вещество Zn и H2SO4. Первое вещество - это цинк, его формула Zn. Атомы этого вещества не образуют молекул, состоящих из двух атомов, как например, водород, поэтому после него нет нижнего индекса 2. А вот молекула водорода состоит из двух атомов, и она похожа на гантель. Вещество H2SO4 - это серная кислота. Ее молекула состоит из двух атомов водорода (поэтому H2), из одного атома серы (S) и четырех атомов кислорода (O4). В итоге получается сульфат цинка (ZnSO4) и водород. Стрелка показывает, что водород улетучивается.
Можно так же использовать и другие металлы и кислоты. Например, растворение железа в соляной кислоте:
Вторую реакцию, в принципе, можно осуществить и в домашних условиях, так как в качестве железа можно взять самый обычный гвоздь, а соляную кислоту можно купить в любом магазине, где продают реактивы. Можно сделать так же соляную кислоту самому, смешав серную кислоту и обычную поваренную соль. Полученную смесь нужно нагреть до 150 градусов Целься. Тогда пойдет реакция и будет выделяться газ хлороводород. Если поймать его и растворить в воде, то получиться соляная кислота. Правда, если у вас есть серная кислота (тоже, кстати продается, или ее можно слить с автомобильного аккумулятора), то для получения водорода можно использовать и ее. Соляная кислота, кстати, часто входит в набор "Юный химик", который тоже свободно продается.
Обратите внимание, что в этой в этой реакцией перед HCl стоит цифра 2. Это означает, что в реакции участвуют две молекулы. То есть, что бы получить одну молекулу хлорида железа и одну молекулу водорода, надо, что бы прореагировали один атом железа и две молекулы соляной кислоты.
Серная кислота дает с железом вот такую реакцию:
2. Взаимодействие кальция с водой. Эта реакция описывается следующим уравнением:
Реакция кальция с водой идет при комнатной температуре. Несмотря на то, что реакция зачастую идет весьма бурно, он относительно безопасна, как правило, ничего не взрывается. Металлический кальций так же бывает в продаже, обычно в виде стружек.
3. Гидролиз гидридов. Например, реакция соединения гидрида натрия с водой:
Как правило, реакция гидролиза гидрида натрия происходит довольно бурно. При этом выделяется довольно едкое вещество - гидроксид натрия. Гидроксид натрия - это щелочь, поэтому, если вдруг вы решили провести такую реакцию сами, будьте осторожны, руки в продуктах реакции не марайте :)
4. Действие щелочей на цинк или алюминий.
Как правило, реакция щелочей с алюминием идет при комнатной температуре, часто это сопровождается разогревом. А вот с цинком реакция идет гораздо слабее. Так же щелочи реагируют с кремнием и железом, тоже при этом выделяется водород. Только вот щелочь для таких реакций нужно брать концентрированную, а смесь немножко подогревать - иначе реакция идет из рук вон плохо.
5. При помощи электролиза. Водород можно получить пропуская электрический ток через раствор щелочей или кислот в воде.
Теперь перейдем к промышленным способом получения водорода. Чем же он отличается от лабораторного способа? Дело в том, что когда водорода нужно много (для чего может потребоваться много водорода, я объясню чуть ниже, после того, как мы разберем промышленные способы получения водорода), перечисленный способы не годятся из за их дороговизны. В случае, когда нам надо совсем немного вещества для химических опытов, то дороговизна реактивов не критичная, в таком маленьком количестве химикаты стоят копейки. Другое дело промышленные масштабы. Попробуй, например, получить много водорода, соединяя железо с серной кислотой. Кислоты не напасешься!
И так, вот как получают водород в промышленных масштабах:
1. Конверсия газов с водяным паром. Например, метана. Смесь нагревают до температуры в 1000 градусов Цельсия, при этом получается такая реакция двухсторонняя реакция:
В дальнейшем, из этой смести различными способами выделят отдельные компоненты либо используют смесь для других этапов производства.
2. Пропускание паров воды над раскаленным косом (каменным углем). При этом, как правило, углерод (из которого состоит кокс) захватывает из воды атом кислорода, окисляясь до оксида углерода:
3. Электролиз водных растворов солей. Например, это может быть поверенная соль - она достаточно дешевая:
4. Каталитическое окисление кислородом. Каталитическое - это значит, что данная реакция идет в присутствии катализаторов - специальных веществ, которые ускоряют прохождение химических реакций.
Обратите внимание, что эта реакция также двухсторонняя, так что водород приходиться выделять из смеси газов различными способами.
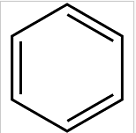
5. Крекинг и риформинг углеводородов в процессе переработки нефти. Крекинг — это высокотемпературная переработка нефти и её фракций с целью получения, как правило, продуктов меньшей молекулярной массы — моторного топлива, смазочных масел и т. п., а также сырья для химической и нефтехимической промышленности. Говоря простыми словами, молекулы нефти - большие и сложные, в процессе крекинга они распадаются на более мелкие молекулы, таким образом получаются различные нефтепродукты - бензин, керосин и прочее. Эта реакция довольно сложная, здесь я ее приводить не буду, но постепенно мы дойдем и до нефти. Риформинг - это промышленный процесс переработки бензиновых и лигроиновых фракций нефти с целью получения высококачественных бензинов и ароматических углеводородов. Ароматические углеводороды - это такие хитрые углеводороды, у которых молекула имеет форму кольца. Химики обозначают такие молекулы вот так:
Лиграновые фракции нефти - это нечто среднее между бензином и керосином. Дело в том, что сама по себе нефть состоит из разных веществ. Когда эти вещества разделят друг от друга, как раз таки получается всякий там бензин, керосин, разные масла и прочее. Разделяют их следующим образом. Нефть как бы кипятят. Так как входящие в состав нефти компоненты имеют разную температуру кипения, то какое то вещество выкипает, а какое то остается. Пары того вещества, которое выкипает, можно собрать и снова сделать жидким. Вот так вкратце выглядит процесс разделения нефти на фракции, который называют перегонкой.
Итак, мы разобрались, как получают водород в лабораторных и промышленных масштабах. Я еще обещал рассказать о том, где, собственно водород применяется, для чего он нужен в таких количествах, что его приходиться получать в промышленных масштабах.
Водород широко применяется:
-
В химической промышленности для производства аммиака, метанола, мыла и пластмасс. Метанол - эта такая разновидность спита. Не путать с этиловым, пить метанол ни в коем случае нельзя - он ядовит!
-
В пищевой промышленности, например, при производстве маргарина из жидких растительных масел.
-
Как топливо водород используется в качестве ракетного топлива.
Теперь поговорим о том, как водород очищают. Дело в том, что в абсолютно чистом виде получить его невозможно, всегда есть какие то примести, независимо от способов. А при промышленном получении часто применяются обратимые реакции, в результате которых образуется смесь водорода с другими веществами, которые, к тому же, постоянно реагируют друг с другом (см. промышленные способы получения водорода, которые я описал чуть выше).
Итак, вот способы очистки водорода:
-
Низкотемпературная конденсация. Смесь охлаждают до температуры -158оС. При такой температуре, как правило, такие газы как метан или этан переходят в жидкое состояние. А что касается водорода, то он конденсируется при значительно более низкой температуре -253оС.
-
Адсорбционное выделение на цеолитах. Цеолиты - это такие минералы, которые могут адсорбировать (впитывать, как губка) определенные вещества, например, воду. Процесс производят на специальных установках, в которых получают водород с чистотой 99%.
-
Абсорбционное выделение жидкими растворителями. Этот метод применяется редко, хотя водород получается высокой чистоты 99,9%.
В заключение урока, о химических свойствах водорода. Как я уже говорил, молекула водорода достаточно прочная, поэтому при комнатной температуре он очень неохотно вступает в реакцию. В обычных условиях водород вступает в реакцию только с кальцием (образуется гидрид кальция):
и фтором (образуется второводород):
Причем, первая реакция проходит плохо, для ускорения лучше всего кальций или водород нагреть, тогда реакция будет идти быстрее. А вот что касается второй реакции, то она происходит даже в темноте и со взрывом. Поэтому ни в коме случае не стоит смешивать фтор и водород.
Реакция водорода с хлором проходит только на свету, но тоже со взрывом (образуется соляная кислота):
С большинство же металлов и неметаллов водород реагирует либо при повышенной температуре, либо при каком то ином воздействии, например, при освещении. Одна из таких реакций вам уже известна, о ней я писал выше, реакция соединения с кислородом и образование воды:
С азотом (образуется аммиак):
Водород может реагировать с некоторыми оксидами, как бы "отнимая" у них кислород (так называемые восстановительные реакции), например:
Водород также реагирует с другими оксидами, например, с оксидом кобальта:
С оксидом железа (в быту оксид железа известен как ржавчина):
С оксидом вольфрама:
Водород реагирует и с углеродом (в виде сажи), при этом образуется газ метан (который горит у нас газовых плитах):
Водород реагирует со щелочноземельными металлами, образуя гидриды:
На этом пожалуй, все, что я хотел рассказать о водороде. Но, может возникнуть вопрос: а почему реакции именно такие? Почему с одними веществами водород реагирует при комнатной температуре, а с другими только при нагревании. Почему одна реакция протекает со взрывом, а другая спокойно? Почему металлы растворяются в кислоте? Ответы на эти и многие другие "почему" будут в будущих уроках.