| Химия для чайников. Урок 3. Таблица Менделеева. |

|

|
| Автор megabax | |
| 06.01.2020 г. | |
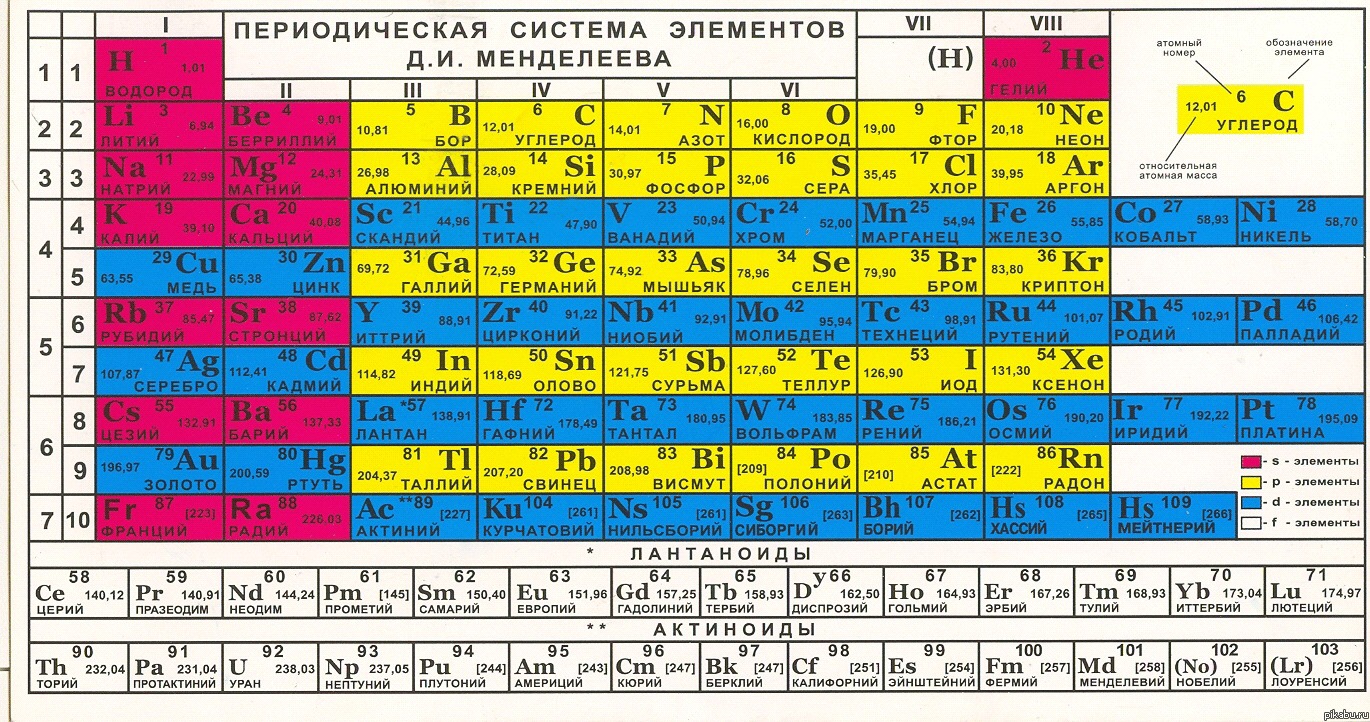
Химия для чайников. Урок 3. Таблица Менделеева.На прошлом уроке я кратко рассказал вам о том, что же такое химические элементы. На сегодняшний день таких элементов известно более сотни. Поэтому их надо как то классифицировать, что бы не запутаться. Менделеев придумал гениальный способ такой классификации - специальную таблицу, которая как то приснилась ему во сне. В чем же гениальность такой таблицы? Давайте посмотрим ее: Что мы тут видим? Во первых, 8 основных столбцов (всего столбцов 18) и 7 основных строк, плюс еще кое какие элементы, которые не укладываются в систему и выделенные отдельно. В данной таблице они беленькие и расположены внизу. Это так называемые f-элементы. В первой строке таблицы Менделеева только два элемента - водород и гелий. Это связана с тем, что на первом энергетическом уровне в атоме можно разместить только два электрона. Что это за уровни, мы еще до этого дойдем. А пока воспринимайте водород и гелий как своего рода исключения из правил, точно так же как "беленькие элементы". А вот дальше у нас идут нормальные строчки. Две первые по 8 столбцов, остальные по 18. При переходе от левого столбца к правому в пределах одной строки атомы химических элементов хуже отдают свои электроны и становятся все более "жадными" - стремятся наоборот, забрать электроны у других атомов. Но вот в восьмом столбике атомы не забирают и не отдают электроны. Это так называемые инертные газы (см . самый конец урока 2). Номера элементов считаются по столбцам слева направо, и переходят к следующей строке. Эти номера совпадают с количеством протонов в ядре атома. От количества протонов зависят физические и химические свойства элементов, и эти зависимости повторятся сначала через 8, а потом через 18 элементов. Поэтому таблица имеет такой вид. Вот в чем ее гениальность. Через строки и столбцы таблицы наглядно показан так называемый периодический закон. Этот закон в 1811 году был сформирован Д. И. Менделеевым вот в такой формулировке: "свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса". Как показали дальнейшие исследования, периодичности подвергаются энергия ионизации атомов, электроотрицательность ( см. Урок 2), радиусы атомов, степень окисления (что это такое, узнаете из будущих уроков) и многие другие характеристики атомов. И все эти периодичности укладывается в Таблицу Менделеева. Для периодов с 18 столбцами характерная следующая закономерность: первые 10 элементов периода имеют характерные ярко выраженные металлические свойства, а остальные 8 практически в точности повторяют 8-ми столбовые периоды. Поэтому и в таблице они расположены соответствующим образом. Рассмотрим, например, ряд 2. Он начинается с лития и бериллия, которые представляют собой типичные металлы. Бор, который идет после бериллия, уже не металл. Далее, идет углерод, то неметалл. После него следуют газы: азот, кислород, втор. Последний является сильным окислителем. После него ярд завершает инертный газ неон ( см. так же Урок 2). После неона с атомным номер 10 следует натрий, у него атомный номер 11, но он лежит уже в следующем ряду, поэтому его свойства резко отличаются от неона. Во первых, натрий - это металл, причем очень активный. На воздухе он очень быстро "ржавеет" (окисляется). Аналогичными свойствами обладает магний. После него следует алюминий, тоже как известно, металл. Сравните, бор, который в таблице Менделеева расположен сверху над алюминием, металл. Так что свойства меняются не только от столбца к столбцу, но и из ряда в ряд. За алюминием следует кремний, это не металл, но он обладает очень интересным свойством: полупроводимость. То есть, кремний ведет себя и как проводник, что свойственно металлам, и как изолятор, что характерно для неметаллов. Такое его экзотическое свойство широко применятся в полупроводниковых приборах, таких как диоды и транзисторы. Эти полупроводниковые приборы являются основами элементами микросхем, используемых в компьютерах. За кремнием следуют фосфор и сера, которые в отличии от своих верхних соседей - азота и кислорода являются твердыми веществами. А вот после серы идет хлор, который является газом и при том сильнейшим окислителем. Ряд завершает аргон - интерны газ. А вот в ряду 4 начинаются некоторые "приколы". Как я уже говорил, первые его 10 элементов являются металлами, остальные 8 чем то повторяют "восьмерку" из рядов 2 и 4. Допустим, калий. Это такой же активный металл, как и натрий. По своим свойствам это как два брата близнеца, хотя отличия, в них, безусловно есть. Потом идет кальций, так же чем то похожий на магний. Но уже не так сильно, как калий на натрий. После него стоит в таблице скандий. По своим химическим свойствам он чем то похож на алюминий. Его степень окисления +3. Далее следует титан, в таблице он расположен под кремнием, но в отличи от него, является металлом (все первые 10 элементов большого ряда, как вы помните, металлы). Потом идем ванадий, далее хром. Интересная особенность хрома в том, что его степень окисления может быть +3, +2 и +6. А вот у марганца, который идет после хрома, степень окисления уже может принимать +2, +3, +4, +6 и даже +7. После него идет железо, для которого характерна степень окисления +2, +3 и +6. И, десятку замыкают кобальт и никель, после которых начинается обычная восьмерка, начинаемая металлами (медь, цинк) и замыкаемая инертным газом (криптон). Свойства элементов меняются так же в пределах одного столбца, от строки к строке. Возьмем, например, столбец 1. В строке 2 у нас стоит литий. Это серебристо белый металл, очень легкий, его плотность 0,533 г/с3. По сути, этот метал даже в воде не тонет. Правда, в воду его опускать не стоит, произойдет химическая реакция, хотя и весьма спокойная, без взрывов и бурного шипения. Но в результате этой реакции получиться щелочь, которая непременной разъест кожу, если попадет на руки или на другую открытую часть тела. После лития вниз под столбцу идет натрий. Он уже более тяжелый, плотность 0,968 г/с3, почти как у воды. Но, тем не менее, так как его плотность меньше плотности воды, натрий тоже в воде не тонет. Но если литий в воду опускать не стоит, то натрий - не стоит категорический! Потому что тогда будет большой бабах. Натрий очень активный, на воздухе быстро окисляется (ржавеет), в воду его опускать, как я уже говорил, нельзя. Поэтому его хранят в керосине. Ниже за натрием идет калий. По плотности он чуть меньше, но такой же активный. С водой реагирует так же со взрывом, на воздухе быстро окисляется. По сути, натрий и калий похожу друг на друга, как два брата близнеца. Медь, по своим свойствам, резко отличается от калия, хотя и стоит в таблице ниже его. Это объясняется тем, что она не в основном а в дополнительном ряду. А вот рубидий продолжает "традицию" щелочно-земленых металлов (таких как литий, натрий, калий). в частности, он практически такой же легкий как натрий или калий 1,532 г/с3, и такой же активный. На воздухе бурно реагирует с кислородом, а при наличии следов влаги даже воспламеняется. Еще более активный цезий, на воздухе он вообще воспламеняется сразу. По плотности чуть тяжелее рубидия 1,873 г/с3. Еще есть франций, но его свойства слабо изучены, потому что в больших количествах получить этот металл редко кому удается. Он очень радиоактивный и быстро распадается. Аналогичная закономерность справедлива и для других столбцов таблицы Менделеева.
|
| « След. | Пред. » |
|---|